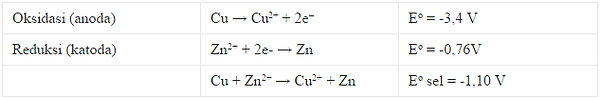Pada kesempatan kali ini, materi yang akan kita bahas adalah elektrolisis. Pada gambar diatas adalah sebuah cincin emas. Menurut kalian, apakah cincin tersebut mengandung 100% emas? Atau malah cincin itu hanyalah emas imitasi? Untuk itu, kita akan mempelajari elektrolisis untuk menguak rahasia – rahsia yang bias terjadi terhadap cincin emas tersebut.
Tujuan dari pembelajaran hari ini adalah siswa diharapkan dapat menjelaskan pengertian, faktor yang mempengaruhi, dan reaksi yang terjadi pada sel elektrolisis serta perbedaan antara sel elektrolisis dan sel volta. Setelah mempelajari materi ini, kita akan mengetahui pengertian, factor yang mempengaruhi, serta reaksi-reaksi yang terjadi pada elektrolisis dan perbedaan antara sel elektrolisis dan sel volta.
Elektrolisis yaitu proses di mana energi listrik dipakai untuk menyebabkan reaksi kimia tidak spontan akan terjadi. Elektrolisis bertanggung jawab atas munculnya banyak benda dalam kehidupan sehari-hari seperti perhiasan berlapis emas / berlapis perak dan bumper mobil berlapis krom.
Sebuah sel elektrolisis yaitu alat yang dipakai untuk melakukan reaksi elektrolisis. Dalam sel elektrolit, arus listrik diterapkan untuk menyediakan suatu sumber elektron untuk mendorong reaksi ke arah tidak spontan. Dalam sel volta, reaksi berjalan dalam arah yang melepaskan elektron secara spontan. Dalam sel elektrolit, masukan elektron dari sumber eksternal memaksa reaksi untuk pergi ke arah yang berlawanan.
Bisa dilihat pada gambar dibawah ini, bagaimana proses elektrolisis ini berlangsung. Serta perbedaan antara sel elektrolisis dengan sel volta. Kalian tentu masih inget pelajaran sel volta sebelumnya kan?
Arah spontan untuk reaksi antara Zn dan Cu yaitu untuk logam Zn akan teroksidasi menjadi ion Zn2 +, sedangkan ion Cu2 + direduksi menjadi logam Cu. Hal tersebut membuat elektroda seng ialah anoda dan elektroda tembaga ialah katoda. Ketika setengah sel yang sama yang terhubung ke baterai melalui kawat eksternal, reaksi dipaksa untuk berjalan dalam arah yang berlawanan. Elektroda seng sekarang katoda dan elektroda tembaga anoda.
Potensi sel standar yaitu negatif, menunjukkan reaksi tidak spontan. Baterai harus mampu memberikan minimal yaitu 1.10 V arus searah agar reaksi akan terjadi. Perbedaan lain antara sel volta dengan sel elektrolitik yaitu tanda-tanda dari elektroda. Dalam sel volta, anoda ialah negatif dan katoda positif. Dalam sel elektrolit, anoda positif karena terhubung ke terminal positif baterai. Katoda karena itu negatif. Elektron masih mengalir melalui sel membentuk anoda ke katoda.
Pada dasarnya elektrolisis adalah sel volta yang bereaksi tidak spontan. Faktanya, aliran listrik harus dibalik dari sel volta dengan melebihkan tegangan yang dibutuhkan. Sel elektrolisis terdiri atas dua buah elektroda, dan satu elektrolit. Tidak seperti sel volta, reaksi yang menggunakan sel elektrolisis harus terinduksi dan terbalik antara anoda dan katoda. Inilah perbedaan sel elktrolisis dengan sel volta secara singkat (bias dilihat di tabel) perbedaan dari keduanya tidak terlalu signifikan, namun hanya berkebalikan.
Seperti sel volta, elektrolisis juga memiliki reaksi-reaksi yang terjadi pada anode maupun katodenya. Untuk lebih ringkasnya, reaksi-reaksi yang terjadi dapat dilihat pada tabel di bawah ini.
Walaupun begitu, tentu saja ada beberapa factor yang dapat mempengaruhi jalannya sel elktrolisis, diantaranya:
-
Overpotential
Tegangan yang dihasilkan akan lebih tinggi dari yang diharapkan. Overpotential penting untuk mengendalikan interaksi antar elektroda.
-
Tipe elektroda
Elektroda Inert berperan sebagai permukaan untuk reaksi yang terjadi. Namun elektroda tidak ikut beraksi dimana elektroda aktif menjadi bagian setengah reaksi.
-
Reaksi Elektrodan yang bersamaan
Jika dua pasang setengah reaksi terjadi bersamaan, maka salah satu setengah reaksi gharus dihentikan untuk menentukan pasangan tunggal reaksi yang dapat dielektrolisis.
-
Keadaan Pereaksi
Jika pereaksi tak standar, maka tegangan setengah sel akan berbeda dari nilai standar. Pada kasus ini, larutan untuk anoda setengah sel mungkin akan mempunyai pH lebih tinggi atau rendah dari pH standar, yaitu 4.