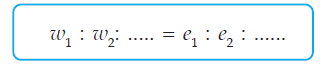HUKUM FARADAY & KEGUNAAN ELEKTROLISIS
Sebelumnya kita telah mempelajari elektrolisis mulai dari pengertiannya, perbedaannya dengan sel volta, reaksi-reaksi yang terjadi paada anoda dan katoda pada sel elektrolisis, serta factor apa saja yang mempengaruhi sel elektolisis. Coba lihat gambar di bawah ini. Tahukah kamu kalo kita bias melapisi plat besi menjadi plat perak. Wah pasti nilai jualnya akan naik jauh lebih tinggi bukan? Benar sekali jika proses yang dilakukan untuk mendapatkan plat perak tersebut adalah elektrolisis.
Namun apakah kalian tahu bagaimana proses tersebut terjadi? Perak kan mahal, jadi jika ingin melapisi plat besi apakah kita bisa mengira-ira berapa massa perak yang dibutuhkan bila kita ingin melapisi plat besi dengan perak tersebut? Tentu saja bisa. Maka dari itu, pada kesempatan hari ini kita akan mempelajari tentang hokum faraday, yaitu hokum yang mendasari tentang perhitungan pada elektrolisis.
Tidak hanya tentang hokum faraday, kita juga akan mempelajari tentang kegunaan elektrolisis bagi kehidupan sehari-hari. So stay tuned ya!
Pada tahun 1834 Michael Faraday menemukan fakta bahwa banyaknya perubahan kimia yang dihasilkan oleh arus listrik berbanding lurus dengan jumlah listrik yang dilewatkan. Fakta ini ditemukan sebelum sifat dasar elektron diketahui. Fakta tersebut kemudian oleh Faraday disimpulkan sebagai Hukum Faraday.
“Massa zat yang terjadi atau melarut selama proses elektrolisis berbanding lurus dengan
jumlah muatan listrik yang melalui sel elektrolisis”
w = massa zat hasil elektrolisis (gram)
e = massa ekuivalen zat hasil elektrolisis, r A e valensi
F = jumlah arus listrik (Faraday)
Karena 1 Faraday setara dengan 96.500 coulomb, sedangkan 1 coulomb = 1 ampere detik, maka Hukum Faraday dapat dijabarkan menjadi
i = kuat arus listrik (ampere)
t = lama elektrolisis atau waktu (detik)
dari rumus tersebut, kita bisa menghitung efesiensi dari elektrolisis yang akan dilakukan. Ada juga hokum faraday 2 yang berbunyi
Bila berbagai larutan elektrolisis bersama-sama dengan arus listrik yang sama, berlaku Hukum Faraday II “Jumlah zat-zat yang dihasilkan oleh arus yang sama dalam beberapa sel yang berbeda sebanding dengan massa ekuivalen zat-zat tersebut.”
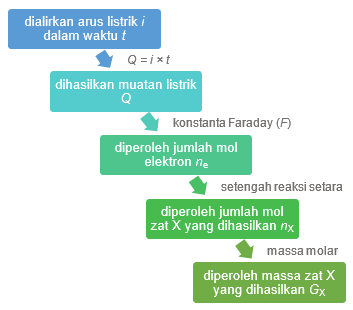
Secara sistematis, hubungan antara jumlah listrik yang dialirkan dengan massa zat yang dihasilkan dalam elektrolisis dapat dilihat pada skema berikut.
Nah, kita kan sudah bisa menghitung, sekarang kita akan mengetahui tentang kegunaan dari elektrolisis dalam kehidupan sehari-hari nih.
1. Pembuatan Beberapa Bahan Kimia
Beberapa bahan kimia seperti logam alkali dan alkali tanah aluminium, gas hidrogen, gas oksigen, gas klorin, dan natrium hidroksida dibuat secara elektrolisis.
Produksi natrium
Sel elektrolisis pada produksi Natrium didapatkan dengan cara elektrolisis lelehan NaCl yang dikenal dengan Proses Down. Reaksi yang terjadi seperti:
Katode : 2 Na+(l) + 2 e– -> 2 Na(l)
Anode : 2 Cl–(l) à Cl2(g) + 2 e– 2 Na+(aq)+2Cl–(aq) -> 2 Na(l) + Cl2(g)
Produksi alumunium
Sel elektrolisis pada produksi Aluminium didapatkan dengan cara elektrolisis bijih aluminium. Reaksi yang terjadi seperti:
Katode : Al3+(aq) + 3 e– -> Al(l)
Anode : 2 O2–(aq) -> O2(g) + 4 e– 4Al3+(aq)+ 6O2–(aq) -> 4 Al(l) + 3O2(g)
2. Pemurnian Logam
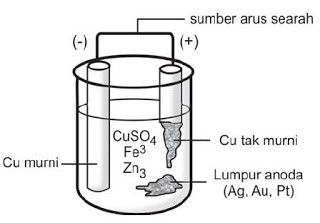
Pada pengolahan tembaga dari bijih kalkopirit diperoleh tembaga yang masih tercampur dengan sedikit perak, emas, dan platina. Untuk beberapa keperluan dibutuhkan tembaga murni, misalnya untuk membuat kabel. Tembaga yang tidak murni dipisahkan dari zat pengotornya dengan elektrolisis.
Tembaga yang tidak murni dipasang sebagai anoda dan tembaga murni dipasang sebagai katoda dalam elektrolit larutan CuSO4 tembaga di anoda akan teroksidasi menjadi Cu2+ selanjutnya Cu2+ direduksi di katoda.
Anoda : Cu(s) → Cu2+(aq) +2e-
Katoda : Cu2+(aq) + 2e- → Cl2(g) + 2e-
Cu(s) → Cu(s)
anoda Katoda
Dengan demikian tembaga di anoda pindah ke katoda sehingga anode semakin habis dan katoda semakin bertambah besar. Logam emas, perak, dan platina terdapat pada lumpur anoda sebagai hasil samping pada pemurnian tembaga.
Gambar 1. Pemurnian tembaga.
3. Penyepuhan Logam
Suatu produk dari logam agar terlindungi dari korosi (perkaratan) dan terlihat lebih menarik seringkali dilapisi dengan lapisan tipis logam lain yang lebih tahan korosi dan mengkilat. Salah satu cara melapisi atau menyepuh adalah dengan elektrolisis. Benda yang akan dilapisi dipasang sebagai katoda dan potongan logam penyepuh dipasang sebagai anoda yang dibenamkan dalam larutan garam dari logam penyepuh dan dihubungkan dengan sumber arus searah.
Contoh : untuk melapisi sendok garpu yang terbuat dari baja dengan perak, maka garpu dipasang sebagai katoda dan logam perak dipasang sebagai anoda, dengan elektrolit larutan AgNO3. Seperti terlihat pada gambar 2.
Gambar 2. Pelapisan sendok dengan logam perak.
Logam perak pada anoda teroksidasi menjadi Ag+ kemudian direduksi menjadi Ag pada katoda atau garpu. Dengan demikian garpu terlapisi. oleh logam perak.
Anoda : Ag(s) → Ag+(aq)+ e-
Katoda : Ag+(aq) + e- → Ag (s)
Ag(s) → Ag(s)
anoda Katoda